丁香通店铺
关于我们
ABOUT US
关于我们
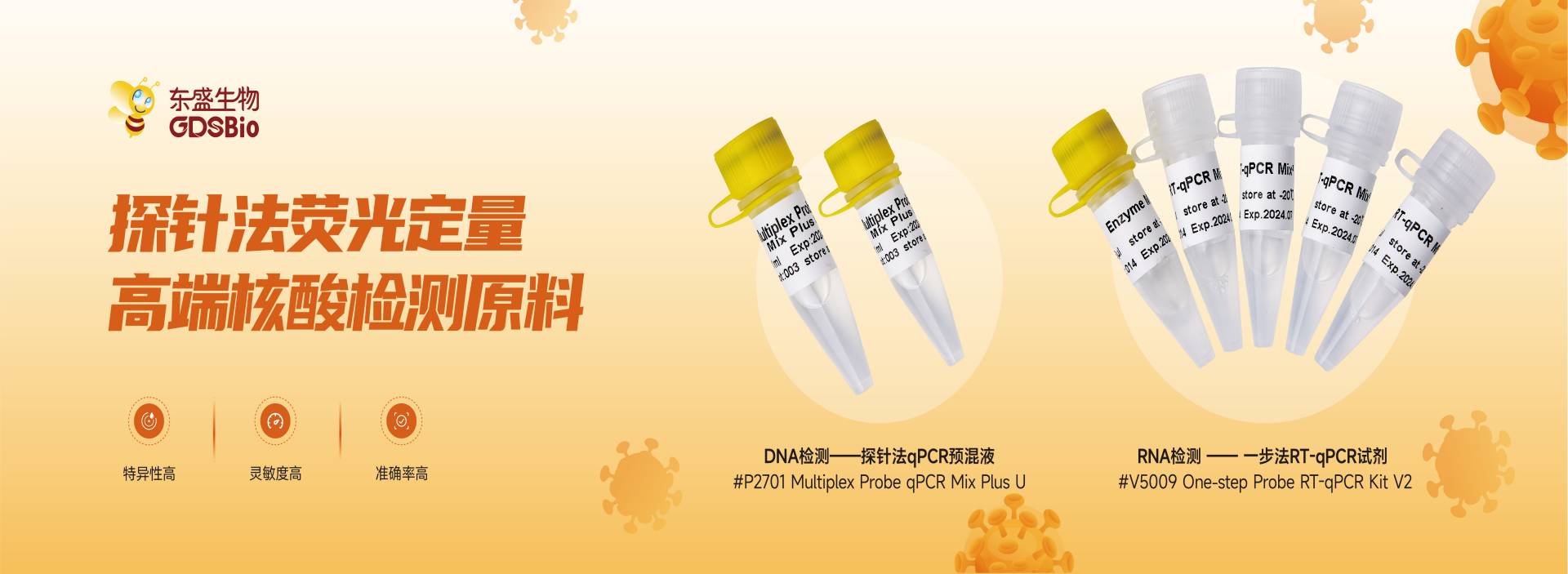
ABOUT US广州东盛生物科技有限公司 广州东盛生物科技有限公司成立于2005年,坐落于广州市黄埔区科学城,是一家专注于研发、生产、销售优质生命科学产品的高新技术企业。公司产品线齐全,以PCR技术为核心,聚焦于普通PCR、荧光定量PCR、NGS建库、核酸电泳等分子生物学技术,开发了分子科研试剂、分子体外诊断原料、核酸提取与检测试剂等产品。完成从基础分子生物学试剂、工业生产原料、体外诊断试剂到专业化服务的全产业链布局。 |
新闻资讯
NEWS
新闻资讯
NEWS- 2024-04-01
- 2024-03-20
- 2024-03-19
- 2024-03-13
欢迎留言
leave your message
欢迎留言
leave your message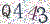 *
*
提交
 欢迎加入我们,与您共创事业 欢迎加入我们,与您共创事业 |


























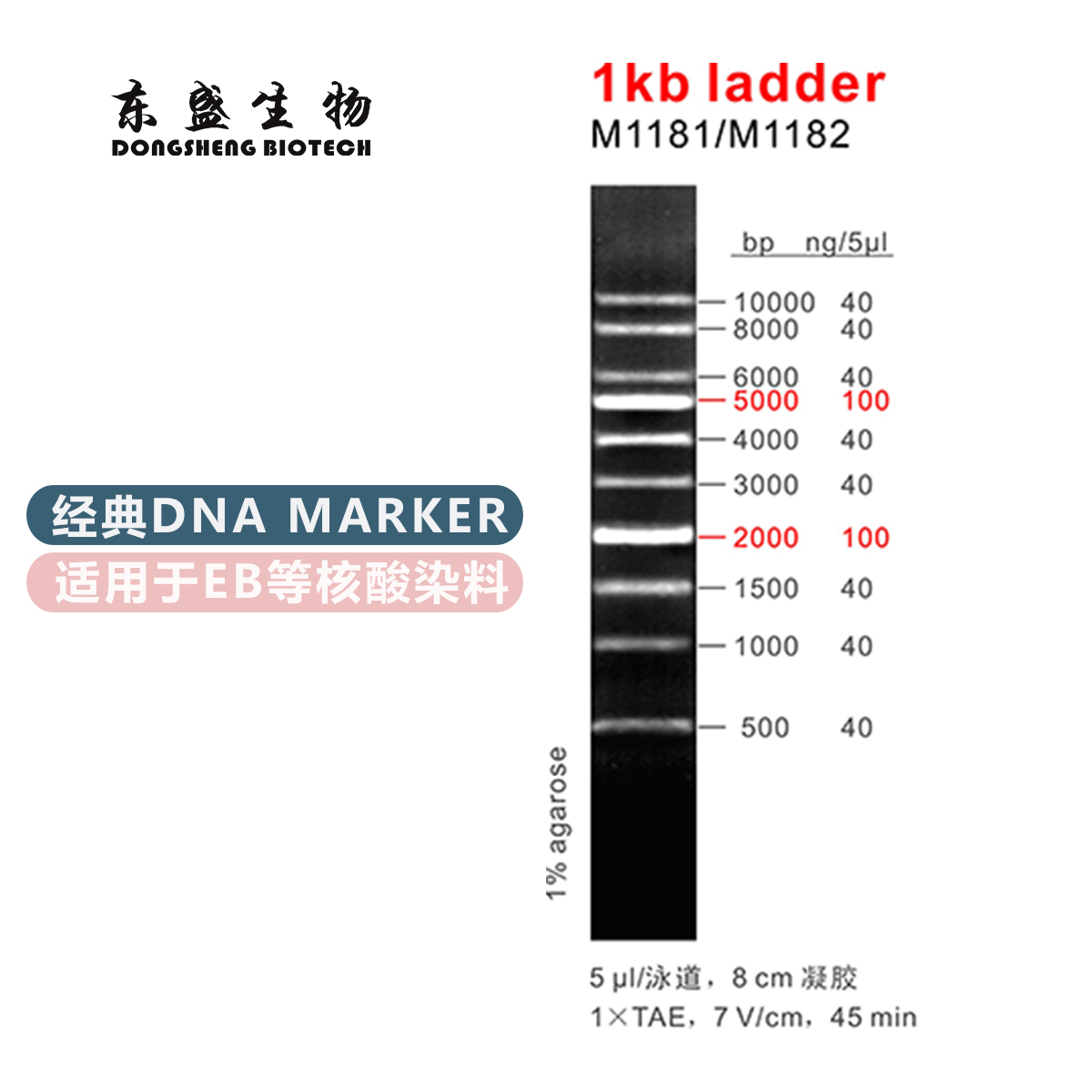

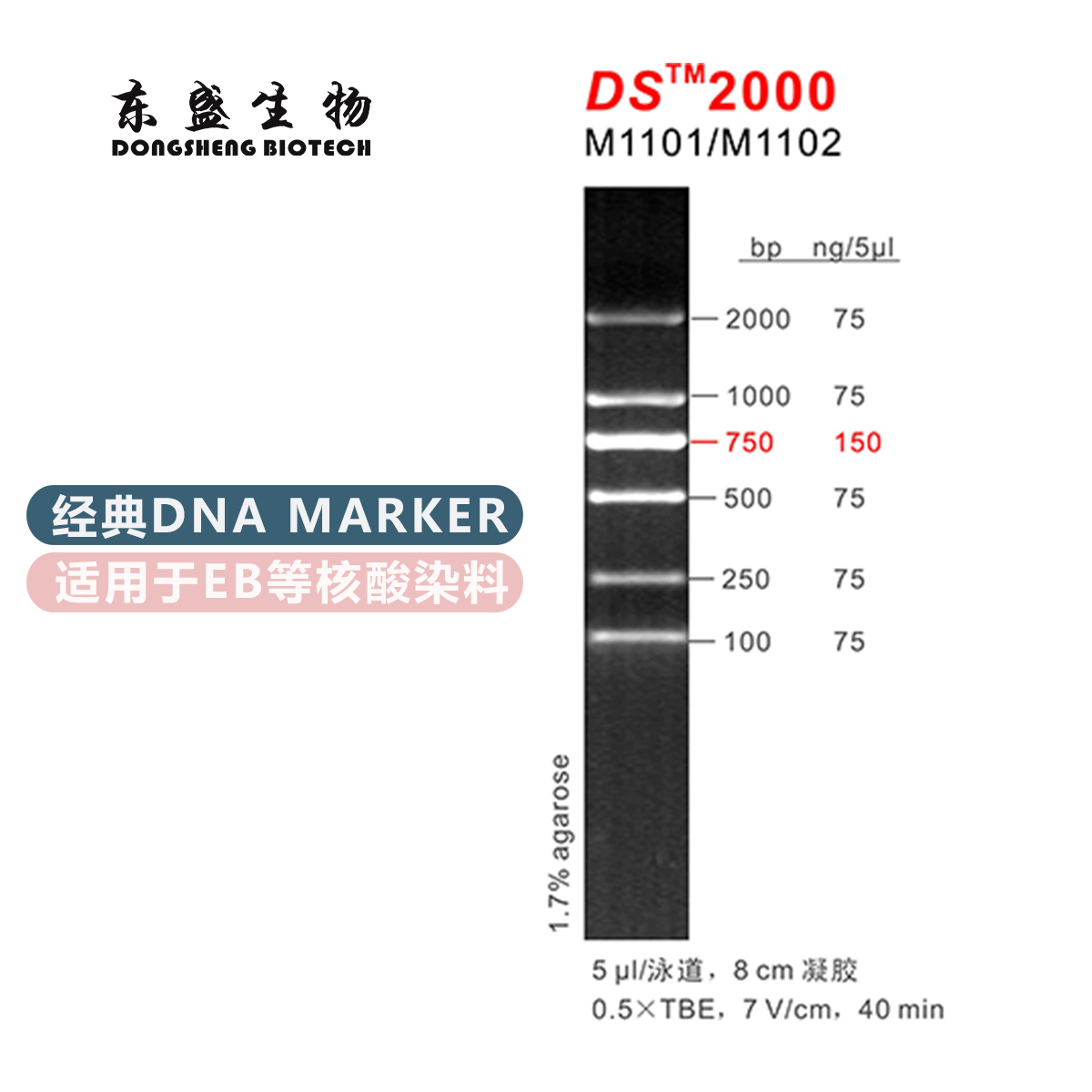

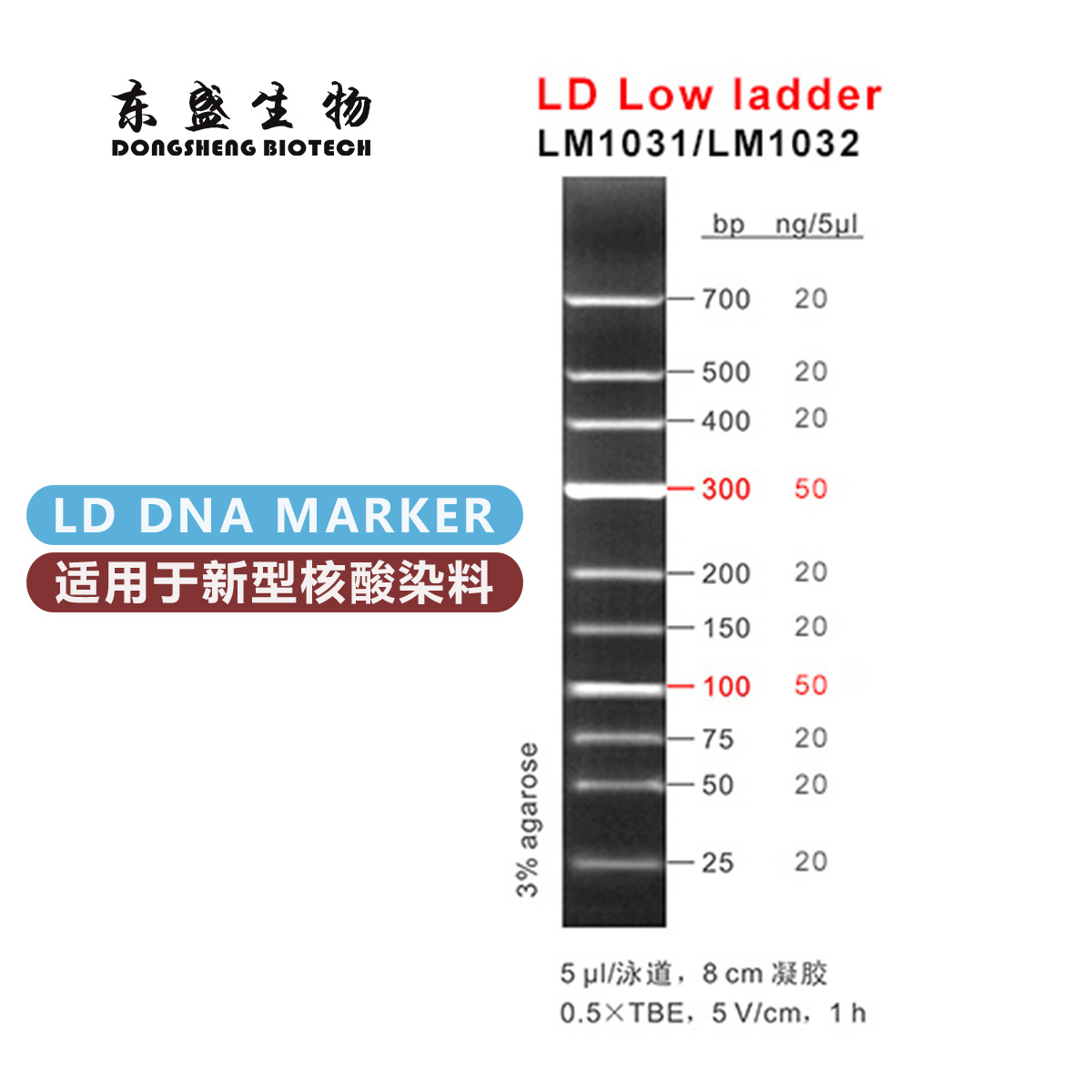
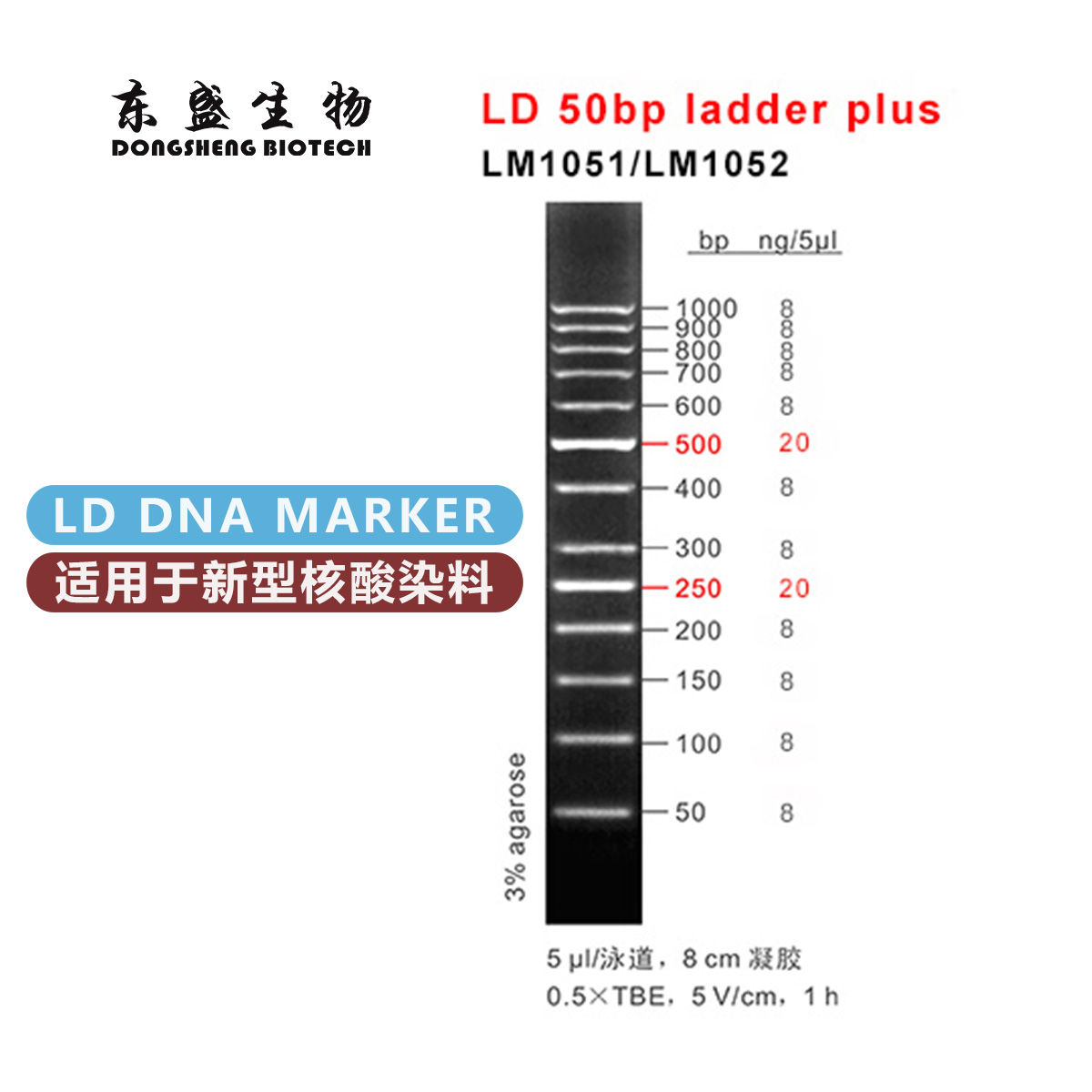
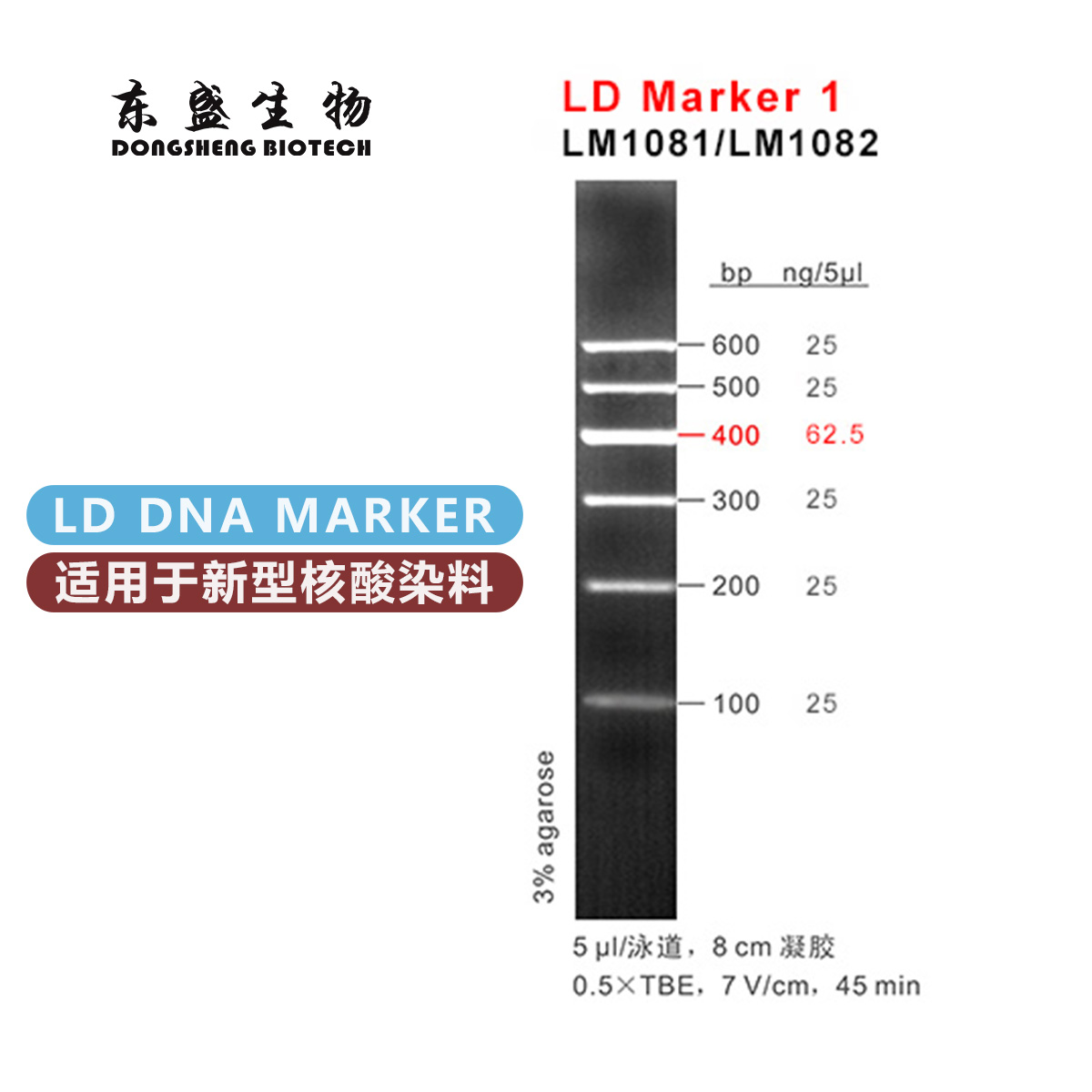
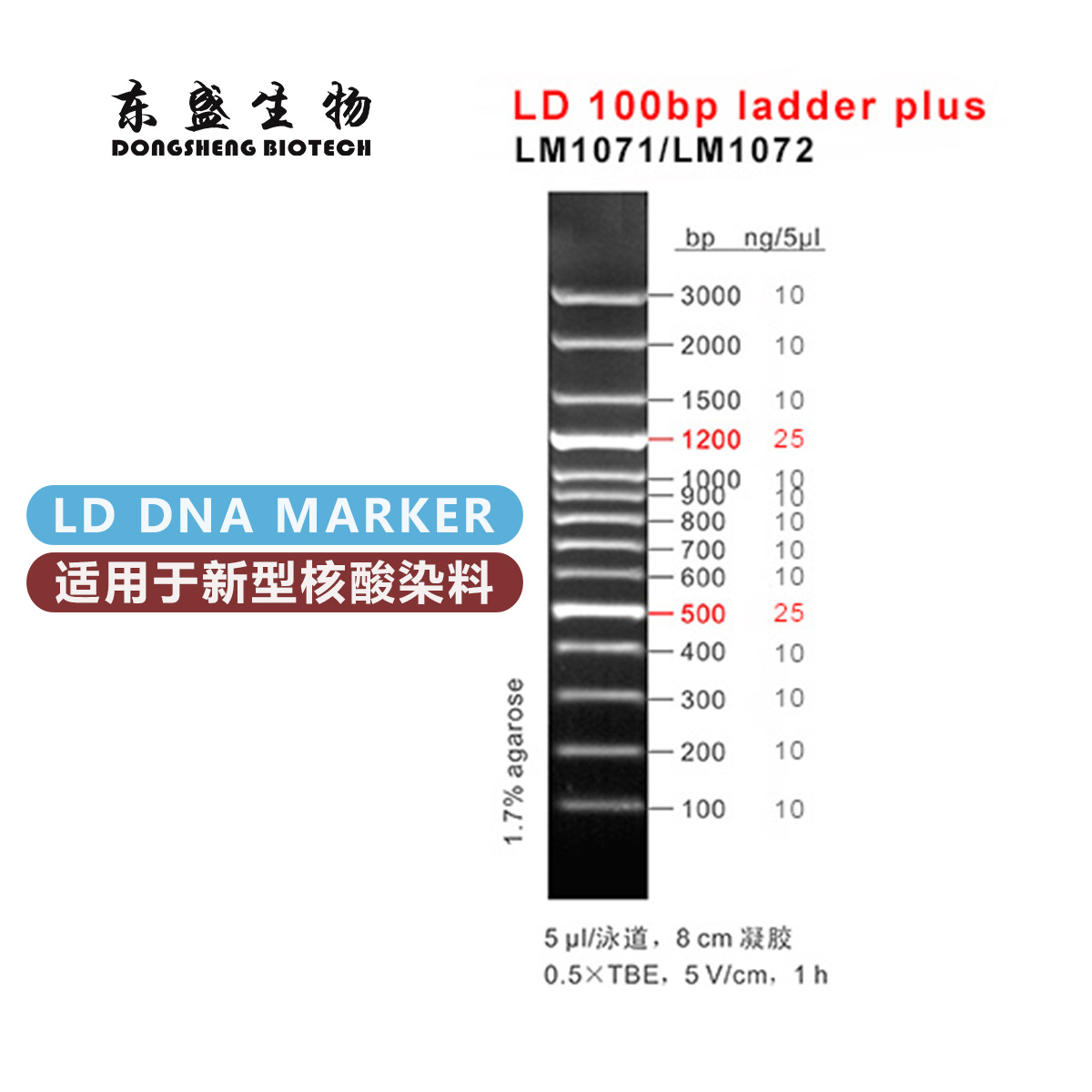


















 电话:020-87791356(国内业务) 020-31600213(海外业务)
电话:020-87791356(国内业务) 020-31600213(海外业务) 销售邮箱:sales@gdsbio.com
销售邮箱:sales@gdsbio.com  技术支持:technique@gdsbio.com
技术支持:technique@gdsbio.com